弊社が取り扱いをしております抗原検査キット(以下本製品)について精度に関するお問い合わせがございましたので、回答いたします。また本キットは研究用試薬であり、診断用としては使用できない旨、改めてご留意ください。
結論から申し上げますと、自社基準ではありますが精度をロットごとに試験しており、基準を満たしている商品のみを販売しております。
本製品は中国産の製品です。もともとご使用ユーザーが中国製で大丈夫か?とご心配される懸念はありました。そこで研究試薬として抗原検査キットを販売するにあたり、体制作りと品質管理をしっかりと行うことで弊社なりに品質の維持に努めてまいりました。体制と品質管理についてご説明いたします。
体制面
体制面についてですが、弊社は体外診断用医薬品の製造販売業許可、第2種医療機器製造販売業許可、医薬品販売業(取扱品目:全ての医療用医薬品、要指導医薬品及び一般用医薬品(小規模卸))もしており、これらの業の許可で必要な人的要件としての薬剤師(医学博士)を雇用しております。
このため研究用試薬としての販売前に、品質チェックを行える体制があり、品質チェックをロットごとにチェックをしております。
品質チェックについて
本製品の抗原検査の原理としては、染色マイクロスフィアを用いた免疫測定法を測定原理としたイムノクロマト技術を使用しています。
当初抗原検査キットは、金コロイド法を使っておりましたが、イムノクロマト法のほうが精度が良いということもあり本製品を採用しました。
ではその精度品質が保たれているかどうかの確認ですが、ポジティブコントロール・ネガティブコントロールを使用して確認しています。
ポジティブコントロールとは一言でいうと、検査キットがちゃんと陽性と反応するか検査するためのものです。
ではポジティブコントロールはどんなものを使用しているのでしょうか。通常はメーカーが製造しているポジティブコントロールを使用します。
ただしここで疑問が生まれます。本当にポジティブコントロールは正確なのでしょうか?
そこで弊社は精度に信頼のおける新型コロナウイルスELISAキット用タンパク質を、日本国内の専門機関を通じて購入しました。
本製品が到着したら、ランダムにサンプル製品の抽出を行います。
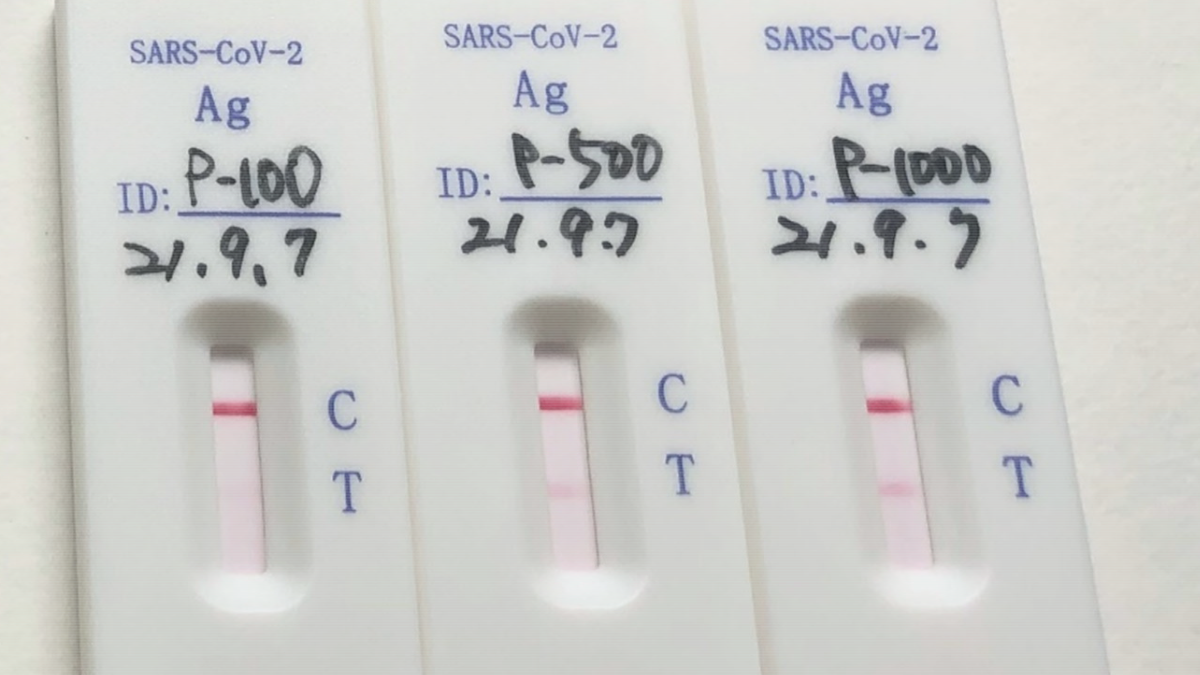
ポジティブコントロールは、強・中・弱反応に振り分けて試験しています。試験は弱・中・強すべてに陽性がでたら適合としています。弊社は適合した製品のみを出荷しています。(試験に適合せず返品したロットもあります。)
体外診断用医薬品が承認されるための要素はいくつかありますが、重要な指標として臨床性能試験において感染研法を用いたPCR検査とのコピー数での比較、既承認品との一致率比較があります。
承認された製品にもよりますし、コピー数の換算式にもよりますが、PMDAの審査報告を見る限り、おおむね400コピー相当以上がが80%~100%一致する精度がポイントだと考えております。
したがって条件が色々違う部分はありますが、少なくても400コピー相当で必ず一致することが出荷する基準であると考えています。
| 量 | コピー数換算 | 出荷判定 | |
| 強反応 | 1,000pg/ml | 4,000copy相当 | 適合のみ |
| 中反応 | 500pg/ml | 2,000copy相当 | 適合のみ |
| 弱反応 | 100pg/ml | 400copy相当 | 適合のみ |
むすびに
弊社製品についてご心配をおかけし大変申し訳ありません。今後も、出荷品の品質維持につとめてまいります。